

Dra. Renata Cangussú | CRM/BA 15.149 | RQE 7.528
Médica oncologista especializada em tumores femininos e oncologista integrativa da Rede D’Or em Salvador, Bahia.
CASO CLÍNICO
Paciente feminina, ex-tabagista, sem histórico familiar de neoplasia.
Comorbidades prévias
Em 2008, estava com 48 anos e pré-menopausada quando foi diagnosticada com câncer de mama.
Linha do tempo
2008
Carcinoma invasivo não especial (CINE) da mama direita, grau 2, medindo 2,4 cm, 1/19 linfonodo com micrometástase (< 2,0 mm), receptor de estrogênio (RE) 90%, receptor de progesterona (RP) 60%, receptor do fator de crescimento epidérmico humano 2 (HER2, do inglês human epidermal growth factor receptor-type 2), imunohistoquímica 2+ (IHQ2+, do inglês immunohistochemistry 2+), fluorescent in situ hybridization (FISH) negativo (escore 1+, specificity protein 3 [SP3] Bacchi), Ki67 < 10%.
A paciente foi submetida a cirurgia conservadora com esvaziamento axilar e recebeu tratamento adjuvante sistêmico com seis ciclos de FAC (fluorouracil, adriamicina e ciclofosfamida).
16/02/2009
À época, a paciente recebeu o tratamento pelo Sistema Único de Saúde (SUS), que só cobria taxano para macrometástase em linfonodo, C6. Recebeu também radioterapia adjuvante em mama residual direita com boost no leito tumoral, dose total de 4.500 cGy em 25 frações (180 cGy/dia na mama e boost de 1.000 cGy em cinco frações no leito tumoral).
Março de 2009
Iniciou terapia endócrina adjuvante com tamoxifeno 20 mg via oral diariamente.
Quando estava próximo de completar 10 anos do primeiro diagnóstico, um novo nódulo mamário, na mesma mama previamente tratada, apareceu nos exames de rotina.
17/07/2009
Painel de câncer hereditário (DNA) variante de significado incerto em PTCH1 (gene patched 1) c.2528T>C.
Janeiro de 2019
Core biópsia da mama direita: carcinoma ductal infiltrante (CDI) RE/RP negativo, IHQ HER 2 0.
Cerca de 30% dos tumores luminais podem perder expressão desses biomarcadores em eventual recidiva.1 Por esse motivo, vale lembrar da necessidade de realizar novas biópsias para avaliar a mudança de perfil molecular.
Com esse achado, a paciente foi encaminhada para mastectomia.
Fevereiro de 2019
Foi submetida a mastectomia simples à direita: CDI grau 3, margens livres. T1c (1,2 cm).
Recebeu seis ciclos de quimioterapia adjuvante com carboplatina AUC (area under the curve) 6 e paclitaxel 175 mg/m2, esquema posteriormente endossado pelo estudo chinês de Yu K-D e cols.2
A paciente ficou em seguimento clínico e, em fevereiro de 2022 (após 31 meses), apresentou uma recidiva linfonodal.
Nova biópsia
IHQ RE/RP - HER 2 0; programmed cell death ligand 1 (PD-L1) + (SP142); breast cancer wild type (BRCA).
A paciente iniciou tratamento de primeira linha com nab-paclitaxel 100 mg/m3 D1, D8 e D15 a cada 28 dias, com atezolizumabe 840 mg D1 e D15, conforme os dados do estudo Impassion 130,3 com excelente tolerância e resposta metabólica completa, como visto na Figura 1. Em fevereiro de 2023, apresentou nova progressão linfonodal (Figura 2).
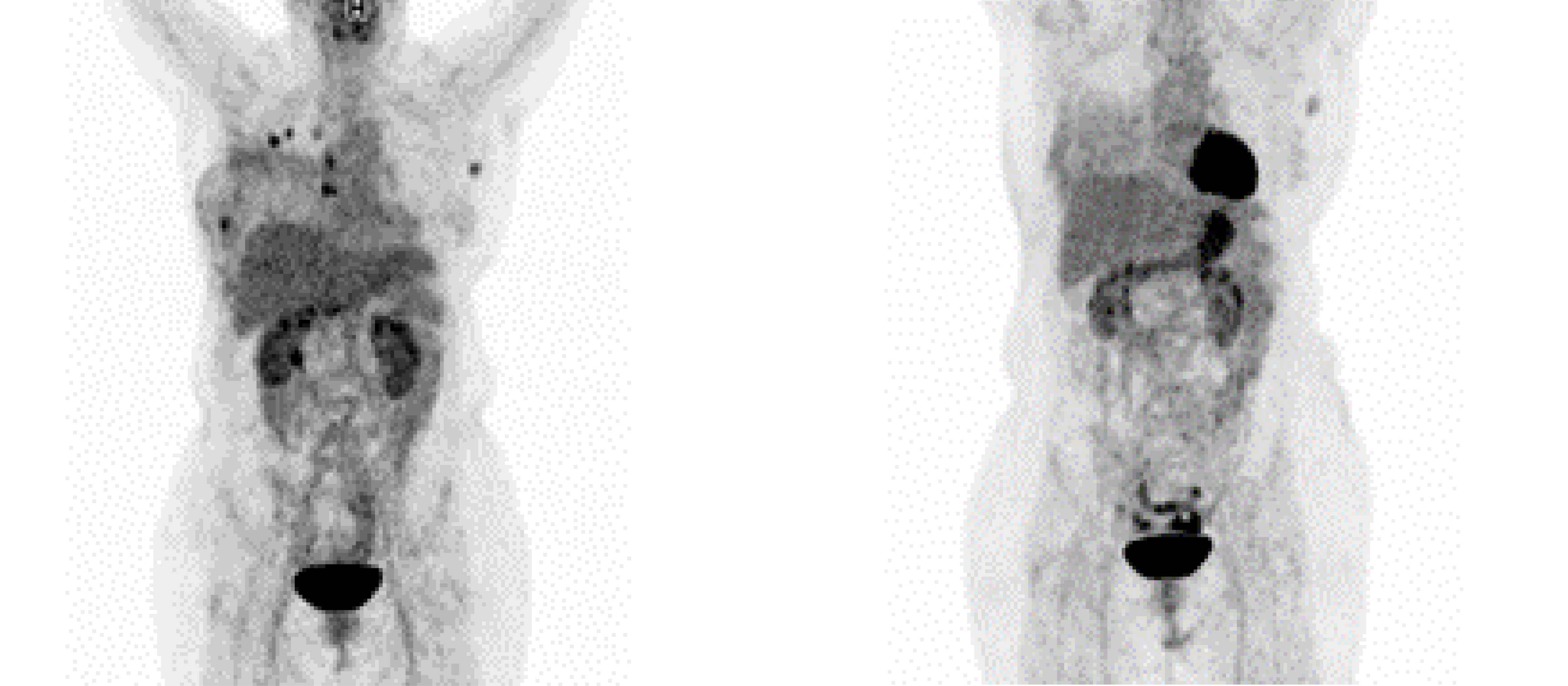
Figura 1. Exame PET Scan (2022).
Fonte: arquivo da autora.
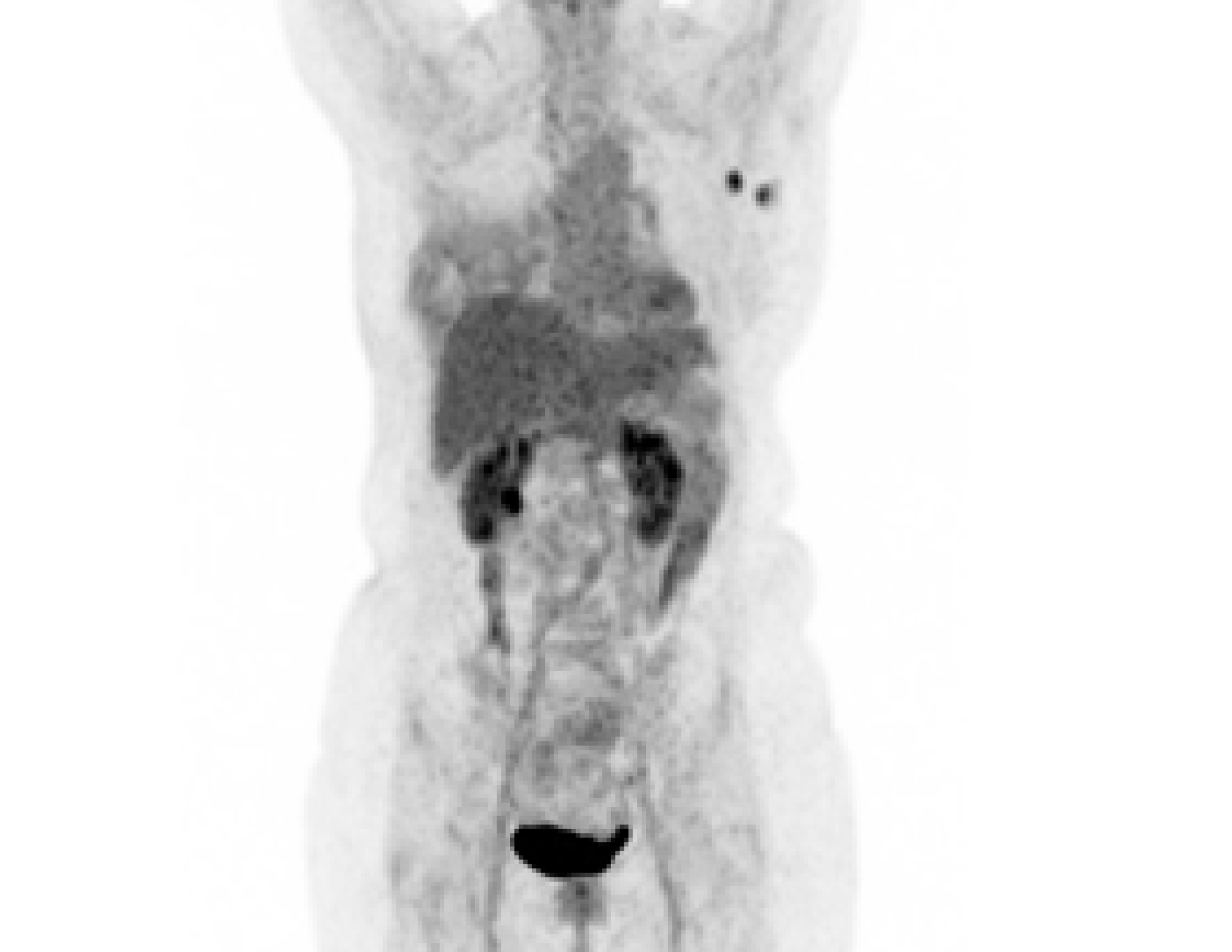
Figura 2. Exame PET Scan (Fevereiro de 2023).
Fonte: arquivo da autora.
PET: tomografia computadorizada por emissão de pósitrons.

Nova biópsia confirmou o mesmo tipo molecular com padrão triplo negativo. Para a segunda linha foi proposto sacituzumabe govitecana, anticorpo droga-conjugado que visa o antígeno 2 da superfície celular trofoblástica (TROP 2) expresso na grande maioria dos cânceres de mama, ligado ao inibidor da topoisomerase I (SN-38).4
Discussão
Essa indicação do sacituzumabe govitecana é baseada nos dados do estudo ASCENT,4 estudo de fase 3 publicado no New England Journal of Medicine (NEJM), que comparou sacituzumabe govitecana com quimioterapia padrão de agente único de escolha do médico (eribulina, vinorelbina, capecitabina ou gencitabina) em pacientes com câncer de mama triplo-negativo metastático (CMTNm) recidivado ou refratário, com o objetivo primário de avaliar a sobrevida livre de progressão (PFS, sigla do inglês Progression-Free Survival). O estudo mostrou que não apenas a PFS, mas também a sobrevida global (SG) foi maior com o sacituzumabe govitecana quando comparado à quimioterapia, independentemente da expressão de TROP 2, não sendo esse um biomarcador.4


PFS: sobrevida livre de progressão; SG: sobrevida global; HR: razão de risco; IC: intervalo de confiança.
Adaptada de: Bardia A, et al., 2021.3
A resposta objetiva também favoreceu o braço experimental, de 35% versus 5%. Com base nos dados do estudo ASCENT, o sacituzumabe govitecana foi incluído como terapia preferencial em segunda linha nos guidelines da European Society for Medical Oncology (ESMO), National Comprehensive Cancer Network (NCCN) e American Society of Clinical Oncology (ASCO).5-7

As toxicidades encontradas foram obstipação grau 2, fadiga grau 2 (que melhorou para grau 1 após atividade física) e cefaleia grau 1. Não apresentou mielotoxicidade ou diarreia.
Após o terceiro ciclo, a tomografia por emissão de pósitrons (PET, do inglês positron emission tomography) Scan foi repetida com resposta metabólica completa, conforme observado na Figura 3.
A paciente seguiu com o mesmo esquema, sem necessidade de redução de dose (necessária em 22% das pacientes no braço experimental. No estudo a descontinuação foi incomum em ambos os braços, em torno de 5%) 4 e boa tolerância.
Após o sexto ciclo, repetiu a PET Scan, que se manteve negativa.
PET: tomografia computadorizada por emissão de pósitrons.
Figura 3. PET Scan após terceiro ciclo.
Fonte: arquivo da autora.
Referências
1. Matsumoto A, Jinno H, Murata T, Seki T, Takahashi M, Hayashida T, et al. Prognostic implications of receptor discordance between primary and recurrent breast cancer. Int J Clin Oncol. 2015;20(4):701-8.
2. Yu K-D, Ye F-G, He M, Fan L, Ma Di, Mo M, et al. Effect of adjuvant paclitaxel and carboplatin on survival in women with triple-negative breast cancer: a phase 3 randomized clinical trial. JAMA Oncol. 2020;6(9):1390-6.
3. Bardia A, Hurvitz SA, Tolaney SM, Loirat D, Punie K, Oliveira M, et al. Sacituzumab govitecan in metastatic triple-negative breast cancer. N Engl J Med. 2021;384(16):1529-41.
4. Mellouli M, Graja S, Kridis WB, Ayed HB, Makni S, Triki M, et al. Discordance in receptor status between primary and metastatic breast cancer and overall survival: a single-center analysis. Ann Diagn Pathol. 2022;61:152044.
5. NCCN [homepage da internet] Login [acesso em 31 out 2023]. Disponível em: https://www.nccn.org/professionals/physician_gls/pdf/breast.pdf.
6. Gennari A, André F, Barrios CH, Cortés J, de Azambuja E, DeMichele A, et al. ESMO Clinical Practice Guideline for the diagnosis, staging and treatment of patients with metastatic breast cancer. Ann Oncol. 2021;32(12):1475-95.
7. Moy B, Rumble RB, Come SE, Davidson NE, Di Leo A, Gralow JR, et al. Chemotherapy and targeted therapy for patients with human epidermal growth factor receptor 2-negative metastatic breast cancer that is either endocrine-pretreated or hormone receptor-negative: ASCO guideline update. Clin Oncol. 2021;39(35):3938-58.
As opiniões emitidas nesta publicação são de inteira responsabilidade da autora e não refletem, necessariamente, a opinião da Conectfarma® Publicações Científicas Ltda. nem do Laboratório Gilead.

© 2023 Conectfarma® Publicações Científicas Ltda. | Todos os direitos reservados. LB 12379-F/23.