

Dr. Stefany Cardoso Faria | CRM/SP 110.950 | RQE 30.894
Médico Oncologista Clínico da Unimed de Campinas.
CASO CLÍNICO
SHGAP, feminino, 68 anos. Diagnóstico de carcinoma metaplásico estadiamento clínico (EC) IIa de mama esquerda inicial triplo-negativo, carcinoma epidermoide medindo 2,1 cm margens exíguas e livres. Imuno-histoquímica (IHQ, do inglês immunohistochemistry): receptores hormonais (RH) negativos HER2 (sigla do inglês human epidermal growth factor receptor-type 2) score 0, ki67 25% na biópsia e ki67 40% no resultado da mastectomia. Paciente iniciaria quimioterapia “neoadjuvante”, mas estava com Covid-19.
Linha do tempo
Fim de julho/agosto de 2021
Após ter negativado para Covid-19, e com melhora do estado clínico, a cirurgia foi novamente discutida com mastologista e a paciente foi submetida à mastectomia total e apresentou biópsia de linfonodo sentinela (BLS) negativa. Durante a cirurgia, foi notada infiltração de pontos de neoplasia em músculo peitoral (ressecados) e em tecido subcutâneo que foi ressecado, evoluindo ressecção de dois terços inferiores do músculo peitoral, e neoplasia se apresentava multicêntrica com vários focos de invasão pelo tecido mamário.
28/10/2023 – 30/12/2021
Após finalizar tratamento cirúrgico, foi feita avaliação de estadiamento com tomografias de tórax, abdômen e pelve, além de cintilografia óssea e estavam negativos para metástases, e proposto tratamento adjuvante com carboplatina + taxol semanal x 12 semanas e seguido de quatro ciclos de FEC100 (5-fluorouracil, epirrubicina e ciclofosfamida).
01/02/2022
Ao completar 12 semanas de quimioterapia e tendo realizado um ciclo de FEC100, realizou CT (tomografia computadorizada) de tórax por crises de dispneia (diante de nova suspeita de Covid-19, não foi confirmado). Encontrados nódulos pulmonares não calcificados no lobo superior inferior direito medindo 0,75 cm (media-se 0,45 cm) e outro de contornos irregulares no segmento apical lobo superior medindo 1,1 cm (media-se 0,3 cm). Paciente foi submetida a ressecção das lesões pulmonares e Pet-SCAN (tomografia por emissão de pósitrons scan) (vide imagens em destaque de locais ressecados e áreas de comprometimento da cadeia mamária interna e região esternal e linfonodo residual).
Após recuperação cirúrgica, a paciente realizou PET-CT em 07/05/2022, revelando (Figura 1):

Linfonodo na cadeia torácica interna esquerda de 1,8 x 1,6 cm ([SUV, do inglês, standardized uptake value] atual = 7,8, SUV anterior = 4,1).

Nódulo pulmonar/linfonodo intrapulmonar no lobo superior do pulmão direito, junto ao feixe vasobrônquico, medindo cerca de 1,0 cm (maior SUV atual = 6,4, maior SUV anterior = 4,1).

Leito cirúrgico de mastectomia esquerda e cavo axilar ipsilateral (SUV = 2,8), de provável natureza inflamatória.

Trajeto de manipulação cirúrgica no hemitórax direito, de natureza inflamatória (SUV = 3,4).

Bandas parenquimatosas no ápice do pulmão direito e segmento superior do lobo inferior ipsilateral, com material de densidade metálica de permeio, correspondendo a locais de manipulação prévia (SUV de até 2,3).
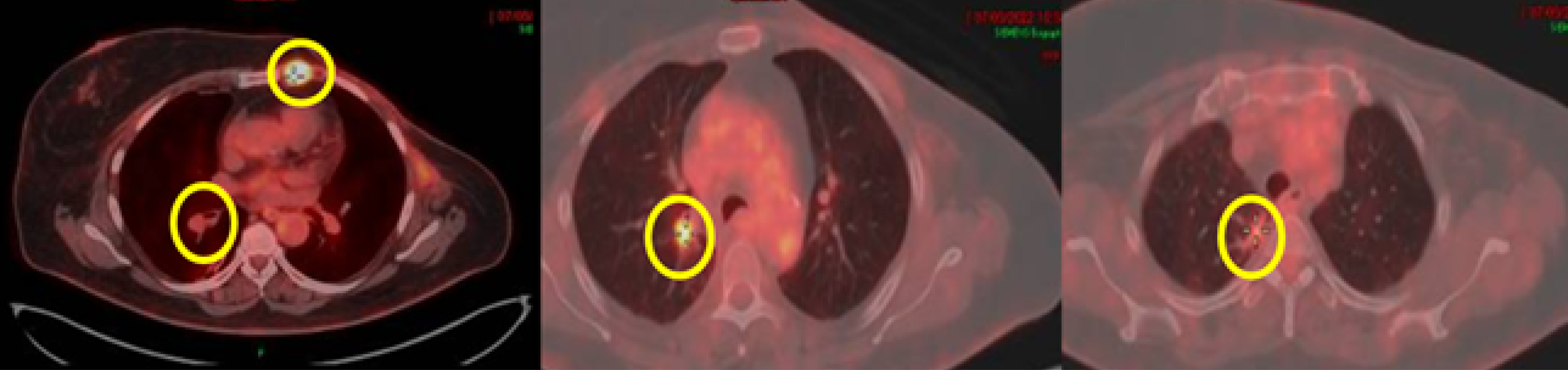
Figura 1. Exame PET-CT realizado em 07/05/2022.
Fonte: arquivo do autor.
Realizado teste Next Generation Sequence (NGS) das lesões pulmonares, em 12/05/2022, oncofoco ampliado. Apresentava PI3KCA p.HIS 1047Arg e HRAS, pGLY 12 Asp. PDL1 > 10%. Realizada proposta de radiocirurgia estereotáxica corpórea (SBRT, do inglês, Stereotactic Body Radiation Therapy) no sítio operado com radioterapia dose total de 40 gy em cadeia mamária interna esquerda e região de hilo pulmonar direito, em 20/05 e 03/06/2022, respectivamente.
Após término de radioterapia, iniciado tratamento com gencitabina + carboplatina e pembrolizumabe, sendo pembrolizumabe feito isolado durante e após radioterapia, por quatro ciclos (16/06 a 18/08/2023), a fim de evitar toxicidade pulmonar por sensibilização aos agentes quimioterápicos. Em seguida, gemcitabina + carboplatina e pembrolizumabe, num total de nove ciclos (08/04/2022 a 12/01/2023). Nesse ínterim, apresentou lesão cutânea dorso lombar ressecada (17/12/2022), sendo identificado carcinoma pouco diferenciado com diferenciação escamosa infiltrando derme e tecido adiposo (ck7+, ck5/6+ p63 +, p40 +, GATA3+fraco, ck20 – cdx2 – RE – RP – HER-2 – SOX-10--, ttf1-, Napsina A--).
Pela recidiva, foi reestadiada com exames de ressonância magnética (RNM) do crânio, negativo para metástases e novo PET-CT: 04/01/2023 (Figura 2) – lesão sólida na parede torácica anterior esquerda, em região paraesternal, com envolvimento dos 2º, 3º e 4º espaços intercostais e sinais de erosão óssea esternal e infiltração das respectivas cartilagens, medindo cerca de 4,8 x 2,2 x 4,6 cm (media 1,8 x 1,6 cm) (SUV = 13,4. Anterior: 7,8); nódulo pulmonar no lobo superior do pulmão direito, peri-hilar, com infiltração do interstício peribroncovascular adjacente, medindo cerca de 2,8 x 2,0 cm (media 1,0 cm), (SUV = 19,1. Anterior = 6,4). Associam-se opacidades do parênquima pulmonar adjacente (SUV de até 3,3); nódulo pulmonar de 1,1 cm no segmento superior do lobo inferior direito (SUV = 2,4); bandas parenquimatosas no ápice do pulmão direito e segmento superior do lobo inferior ipsilateral, com material de densidade metálica de permeio, correspondendo a locais de manipulação prévia (SUV de até 1,9. Anterior de até 2,3), de natureza inflamatória; paredes de cavidade cirúrgica em região dermoepidérmica lombar mediana (SUV = 5,3).
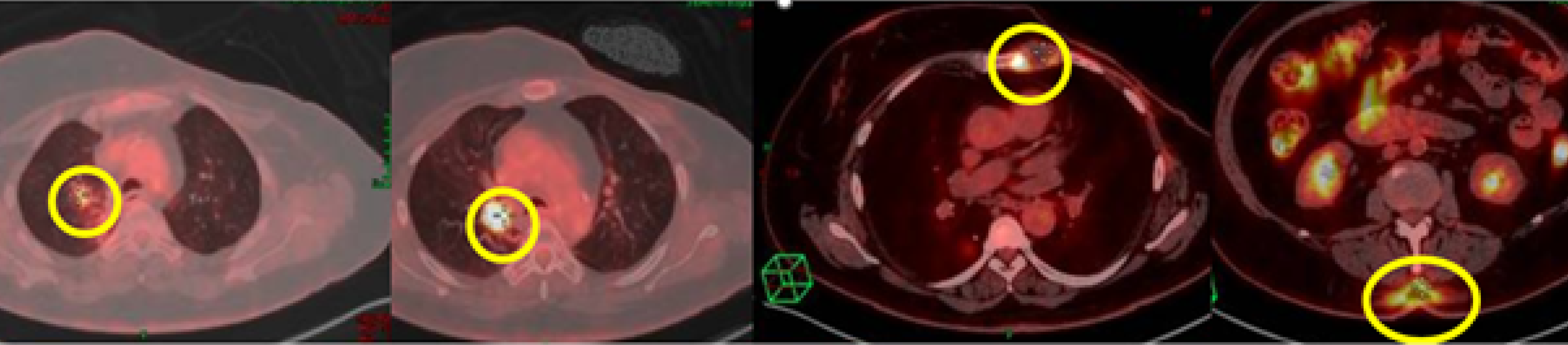

Figura 2. Exames PET-CT realizados em 04/01/2023 e 07/05/2023, após uso de gencitabina, carboplatina e pembrolizumabe, e após ressecção e pré-radioterapia, respectivamente (SBRT - região ressecada + esterno).
Fonte: arquivo do autor.
Dessa forma, após progressão de doença, foi considerada radioterapia com elétrons na região cutânea dorsal, onde foi ressecada lesão nodular metastática, bem como reforço de dose em região pulmonar e esterno. Realização de radioterapia guiada por imagem (IGRT)/radioterapia de intensidade modulada (IMRT), radioterapia ablativa na região de cadeia mamária interna e nodulação de hilo pulmonar e nódulo pulmonar direito 49 gy 5 frações 8 grays, período de 27/01/2023 a 17/02/2023.
Recomendou-se sacituzumabe govitecana, 10 mg/kg D1 D8, a cada 21 dias, com início em 16/03/2023 (mantido até o momento de elaboração deste caso), tendo realizado já cinco ciclos com remissão completa das lesões pulmonares, esternal e cutânea dorso lombar, conforme a Figura 3.
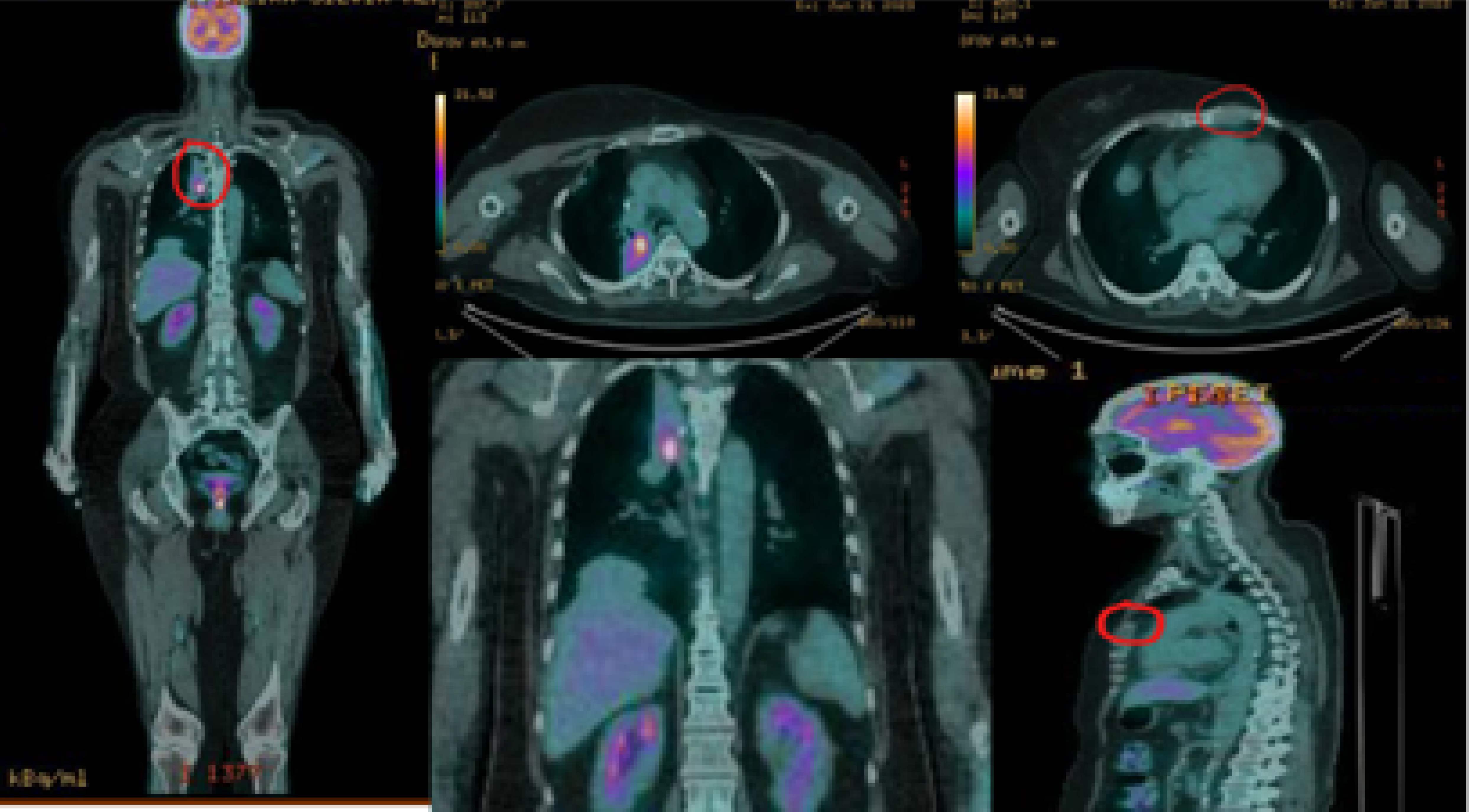
Figura 3. Exame PET-CT realizado em 21/06/2023, no quinto ciclo de sacituzumabe govitecana.
Fonte: arquivo do autor.
DISCUSSÃO
Área focal em meio a atelectasia pulmonar no segmento apical do lobo superior direito, com material espontaneamente hiperatenuante, este possivelmente relacionado a manipulação cirúrgica prévia, de avaliação morfológica limitada neste estudo sem injeção de contraste (SUV máx: 9,6). Redução do hipermetabolismo glicolítico em: linfonodo na cadeia torácica interna esquerda, medindo atualmente 1,2 cm – media 1,6 cm no menor eixo transverso (SUV máx atual: 3,2/prévio: 7,8). Estabilidade do hipermetabolismo glicolítico em: banda atelectásica no lobo inferior direito com áreas hiperdensas de permeio, possivelmente relacionado a manipulação cirúrgica prévia (SUV máx atual: 2,7/prévio: 2,3). Não mais se caracteriza o nódulo pulmonar descrito no lobo superior direito. Resolução do hipermetabolismo glicolítico em: leito cirúrgico de mastectomia esquerda e em trajeto de manipulação cirúrgica no hemitórax direito.
O câncer de mama metaplásico triplo-negativo metastático (CMMTNm) é uma variante rara do câncer de mama terapeuticamente desafiadora e agressiva. O CMMTNm é definido pela presença histológica de pelo menos dois tipos celulares, tipicamente componentes epiteliais e mesenquimais. Essa variante abriga um fenótipo de câncer de mama triplo-negativo (CMTN), mas tem prognóstico pior e menor sobrevida em comparação com o CMTN. Atualmente, não há diretrizes de tratamento padronizadas especificamente para metaplastic breast cancer (MpBC). No entanto, estudos anteriores descobriram que o CMMTNm normalmente apresenta alterações moleculares na transição epitelial para mesenquimal, amplificação do receptor do fator de crescimento epidérmico, sinalização PI3K/Akt, sinalização de óxido nítrico, sinalização Wnt/β-catenina, resposta imune alterada e ciclo celular desregulado.1
Infelizmente, o CMMTNm carrega um prognóstico pior em comparação com o CMTN não metaplásico, tem o dobro do risco de recorrência e tem uma sobrevida livre de doença e sobrevida global (OS) mais curta que o CMTN não metaplásico.2 O termo “carcinoma metaplásico” foi publicado pela primeira vez por Huvos e cols., em 1973.3 Devido à sua natureza rara e agressiva, houve muitas limitações em delinear completamente as características molecular e genética do CMMTNm. No entanto, um número emergente de estudos de caso de CMMTNm, tecnologia aprimorada em pesquisa e maior conscientização sobre essa rara neoplasia de mama, permitiram que médicos e pesquisadores obtivessem melhor compreensão sobre morfologia, prognóstico, alterações moleculares e possíveis opções de tratamento.1
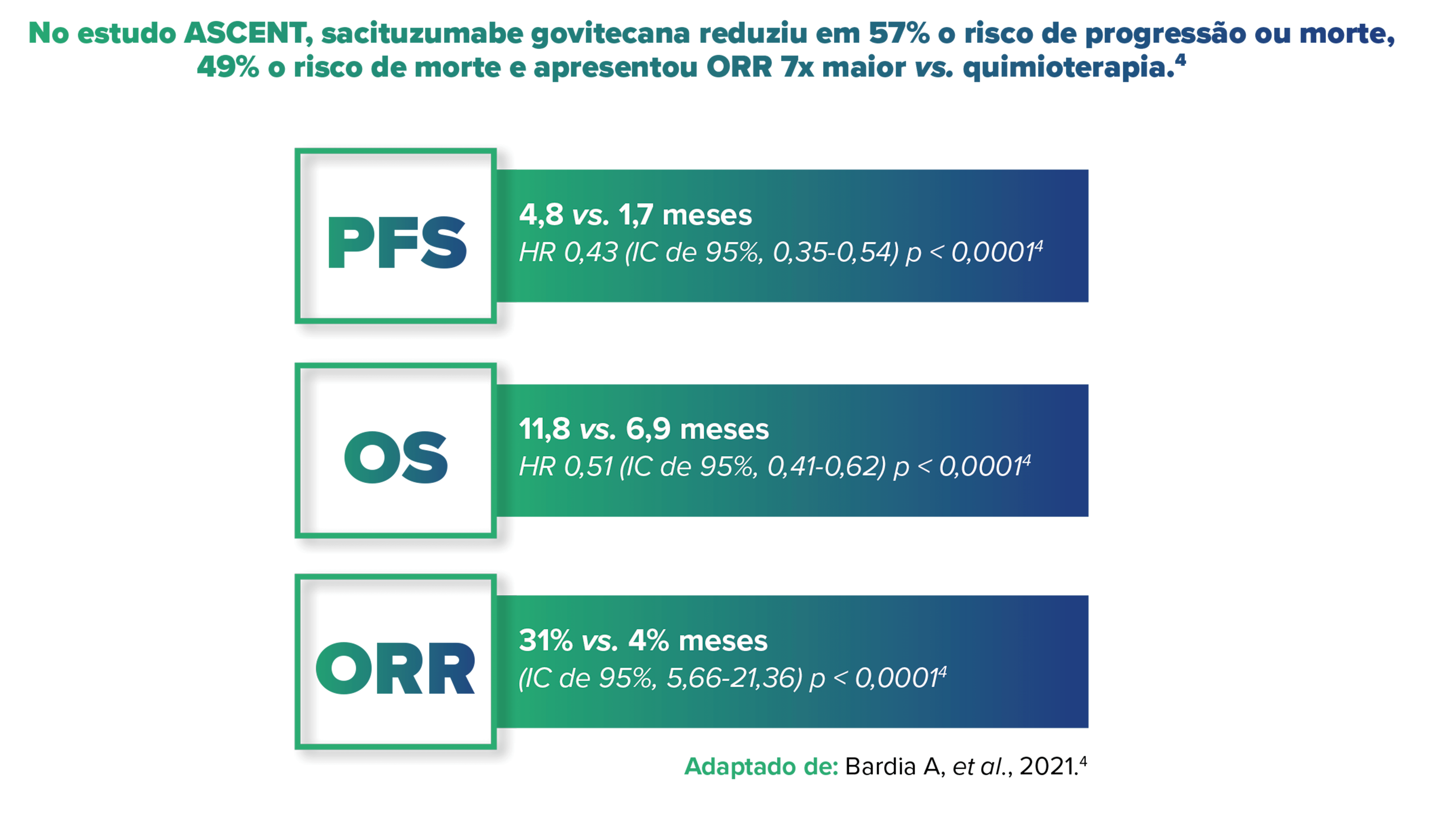
O estudo Ascent fase 3, publicado no New England Journal of Medicine,4 avaliou o sacituzumabe govitecana em comparação com a quimioterapia de agente único de escolha do médico (eribulina, vinorelbina, capecitabina ou gencitabina) em pacientes com CMTN metastático (CMTNm) recidivante ou refratário a partir de segunda linha. O desfecho primário foi a sobrevida livre de progressão (PFS, do inglês progression-free survival). Os pacientes foram estratificados na randomização de acordo com o número de regimes de quimioterapia anteriores para doença avançada (2 ou 3 vs. > 3), a presença de metástases cerebrais conhecidas no início do estudo (sim vs. não) e região geográfica (América do Norte vs. restante do mundo). O tratamento foi continuado até a progressão da doença, efeitos tóxicos inaceitáveis, retirada do estudo ou morte, o que ocorresse primeiro, não sendo permitido cross over de subgrupos de tratamento.4
A escolha de seguir com sacituzumabe govitecana é respaldada pelos principais guidelines, European Society for Medical Oncology (ESMO) e National Comprehensive Cancer Network (NCCN), que recomendam tratamento preferencial com sacituzumabe govitecana para CMTNm a partir de segunda linha.5-8

Referências
1. Weigelt B, Eberle C, Cowell CF, Ng CK, Reis-Filho JS. Metaplastic breast carcinoma: more than a special type. Nat Rev Cancer. 2014;14(3):147-8.
2. Nelson RA, Guye ML, Luu T, Lai LL. Survival outcomes of metaplastic breast cancer patients: results from a US population-based analysis. Ann Surg Oncol. 2015;22(1):24-31.
3. Huvos AG, Lucas JC Jr, Foote FW Jr. Metaplastic breast carcinoma. Rare form of mammary cancer. N Y State J Med. 1973;73(9):1078-82.
4. Bardia A, Hurvitz SA, Tolaney SM, Loirat D, Punie K, Oliveira M, et al. Sacituzumab govitecan in metastatic triple-negative breast cancer. N Engl J Med. 2021;384:1529-41.
5. Gennari A, André F, Barrios CH, Cortés J, de Azambuja E, DeMichele A, et al. ESMO Clinical Practice Guideline for the diagnosis, staging and treatment of patients with metastatic breast cancer. Ann Oncol. 2021;32(12):1475-95.
6. NCCN [homepage da internet] Breast Cancer [acesso em 12 set 2023]. Disponível em: https://www.nccn.org/professionals/physician_gls/pdf/breast.pdf.
7. ESMO [homepage da internet]. EMA Recommends Extension of Therapeutic Indications for Sacituzumab Govitecan [acesso en 04 set 2023]. Disponível em: https://www.esmo.org/oncology-news/ema-recommends-extension-of-therapeutic-indications-for-sacituzumab-govitecan.
8. FDA [homepage da internet]. FDA grants regular approval to sacituzumab govitecan for triple-negative breast cancer [acesso em 04 set 2023]. Disponível em: https://www.fda.gov/drugs/resources-information-approved-drugs/fda-grants-regular-approval-sacituzumab-govitecan-triple-negative-breast-cancer.
9. Bardia A, Mayer IA, Diamond JR, Moroose RL, Isakoff SJ, Starodub AN, et al. Efficacy and safety of anti-Trop-2 antibody drug conjugate sacituzumab govitecan (IMMU-132) in heavily pretreated patients with metastatic triple-negative breast cancer. J Clin Oncol. 2017;35(19):2141-48.
10. Bardia A, Mayer IA, Vahdat LT, Tolaney SM, Isakoff SJ, Diamond JR, et al. Sacituzumab govitecan-hziy in refractory metastatic triple-negative breast cancer. N Engl J Med. 2019;380:741-51.
As opiniões emitidas nesta publicação são de inteira responsabilidade do autor e não refletem, necessariamente, a opinião da Conectfarma® Publicações Científicas Ltda. nem do Laboratório Gilead.

© 2023 Conectfarma® Publicações Científicas Ltda. | Todos os direitos reservados. LB 12379-B/23.