

Dra. Daniela Jéssica Pereira | CRM/MG 71.188 | RQE 53.750
Oncologista Clínica no Grupo Oncoclínicas/Oncocentro e Oncovitta, Belo Horizonte, Minas Gerais. Médica pela Faculdade de Ciências Médicas e da Saúde de Juiz de Fora (FCMS-JF)/SUPREMA. Residência em Clínica Médica na Universidade Federal de Ouro Preto (UFOP). Residência em Oncologia Clínica no Hospital Alberto Cavalcanti (HAC) do Complexo de Especialidades da Fundação Hospitalar do Estado de Minas Gerais (Fhemig).

Profa. Dra. Angélica Nogueira Rodrigues | CRM/MG 37.003 | RQE 12.685
Pós-doutorada em Oncologia pela Harvard University, EUA. Professora e pesquisadora na Universidade Federal de Minas Gerais (UFMG). Fundadora do Grupo Brasileiro de Tumores Ginecológicos - EVA. Chair Ginecologia Oncológica do Latin American Cooperative Oncology Group (LACOG). Diretora da Sociedade Brasileira de Oncologia Clínica (SBOC). Diretora da DOM Oncologia.
CASO CLÍNICO
Paciente do sexo feminino, 60 anos de idade, natural e residente em Minas Gerais.
Comorbidades prévias
Hipertensão arterial sistêmica (HAS) e diabetes mellitus não insulino-requerente (DMNIR) bem controlados. Histórico ginecológico/obstétrico (HGO): G0P0A0. Sem história familiar de neoplasia.
Linha do tempo
08/06/2022
Carcinoma metaplásico de mama esquerda cT4cN0M0 triplo-negativo grau 3.
24/06/2022
KEYNOTE-522.1 AC (doxorrubicina e ciclofosfamida) + pembrolizumabe.
08/08/2022
Quarto ciclo de AC + pembrolizumabe.
22/08/2022
KEYNOTE-522.1 Carboplatina + paclitaxel + pembrolizumabe.
19/09/2022
Segundo ciclo de carboplatina + paclitaxel/semanal.
30/09/2022
Mastectomia + esvaziamento axilar.
Novembro de 2022
KEYNOTE-522.1 Pembrolizumabe adjuvante.
Fevereiro de 2023
PET-CT (tomografia por emissão de pósitrons): linfonodomegalias mediastinais, paratraqueal, para-aórticas, hilo pulmonar esquerdo e axila esquerda. Nódulos pulmonares maiores que 2,3 x 2 cm, SUV (standardized uptake value) de 9,21.
27/03/2023
Sacituzumabe govitecana.
25/05/2023
PET-CT: involução de linfonodomegalias, persistindo apenas paratraqueal com dimensões estáveis. Involução de nódulos pulmonares. Resposta metabólica parcial e significativa.
21/07/2023
PET-CT: redução das dimensões de linfonodo paratraqueal.
23/10/2023
PET-CT: resposta completa.
23/01/2024
PET-CT: resposta completa.
DIAGNÓSTICO
Diagnóstico de carcinoma metaplásico de mama esquerda grau 3 triplo-negativo (HER2 zero, do inglês human epidermal growth factor receptor-type 2) cT4cN0M0 em junho de 2022. Foi submetida à quimioterapia neoadjuvante aos moldes do estudo KEYNOTE-522,1 tendo sido iniciado protocolo de primeira fase com doxorrubicina e ciclofosfamida, concomitantemente com imunoterapia com pembrolizumabe. Ao final da primeira fase, não houve resposta objetiva (Figura 1). Iniciada segunda fase com carboplatina e paclitaxel semanalmente e mantido pembrolizumabe. No segundo ciclo, houve progressão à avaliação clínica (Figura 2).
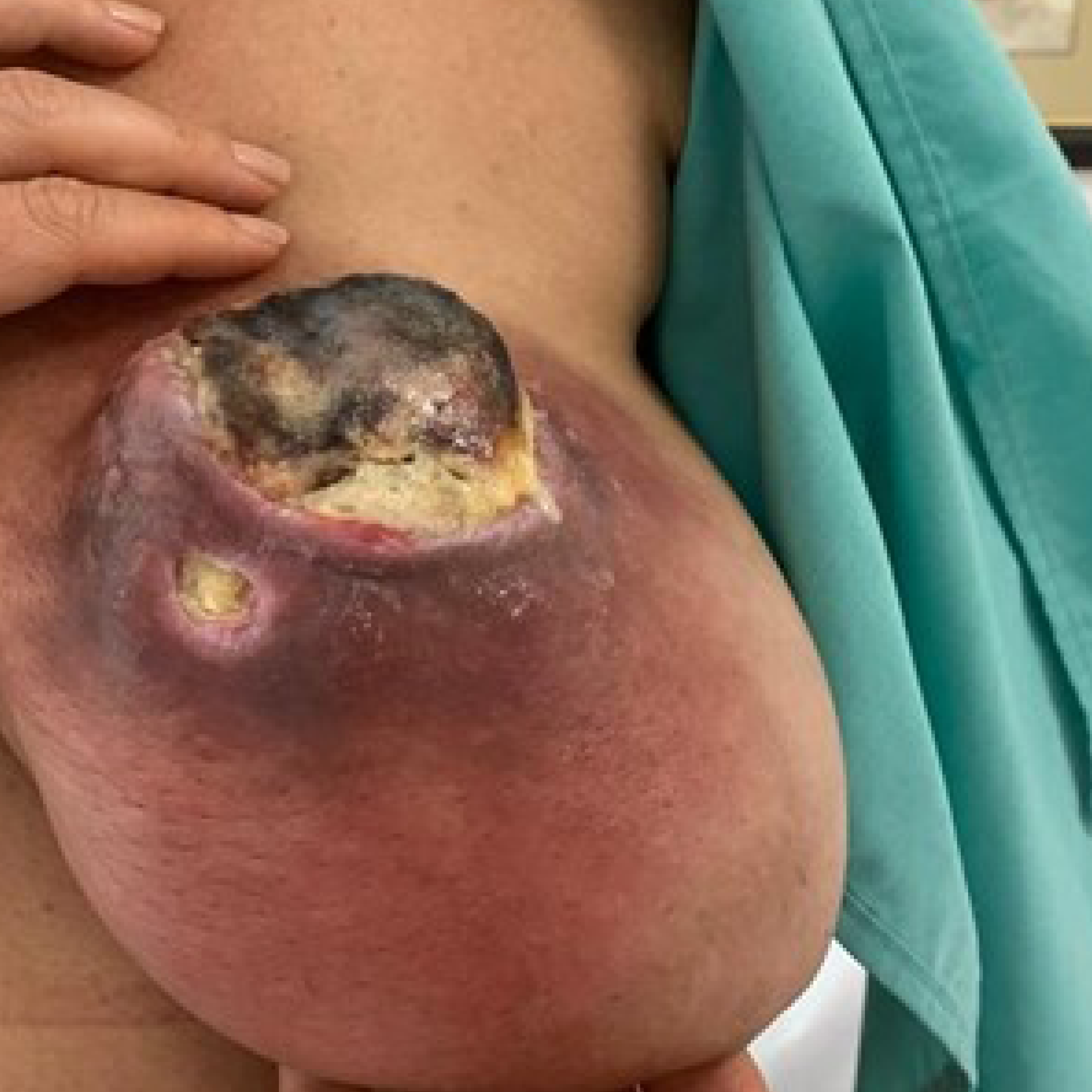
Figura 1. Quarto ciclo de AC + pembrolizumabe.
Fonte: arquivo da autora.
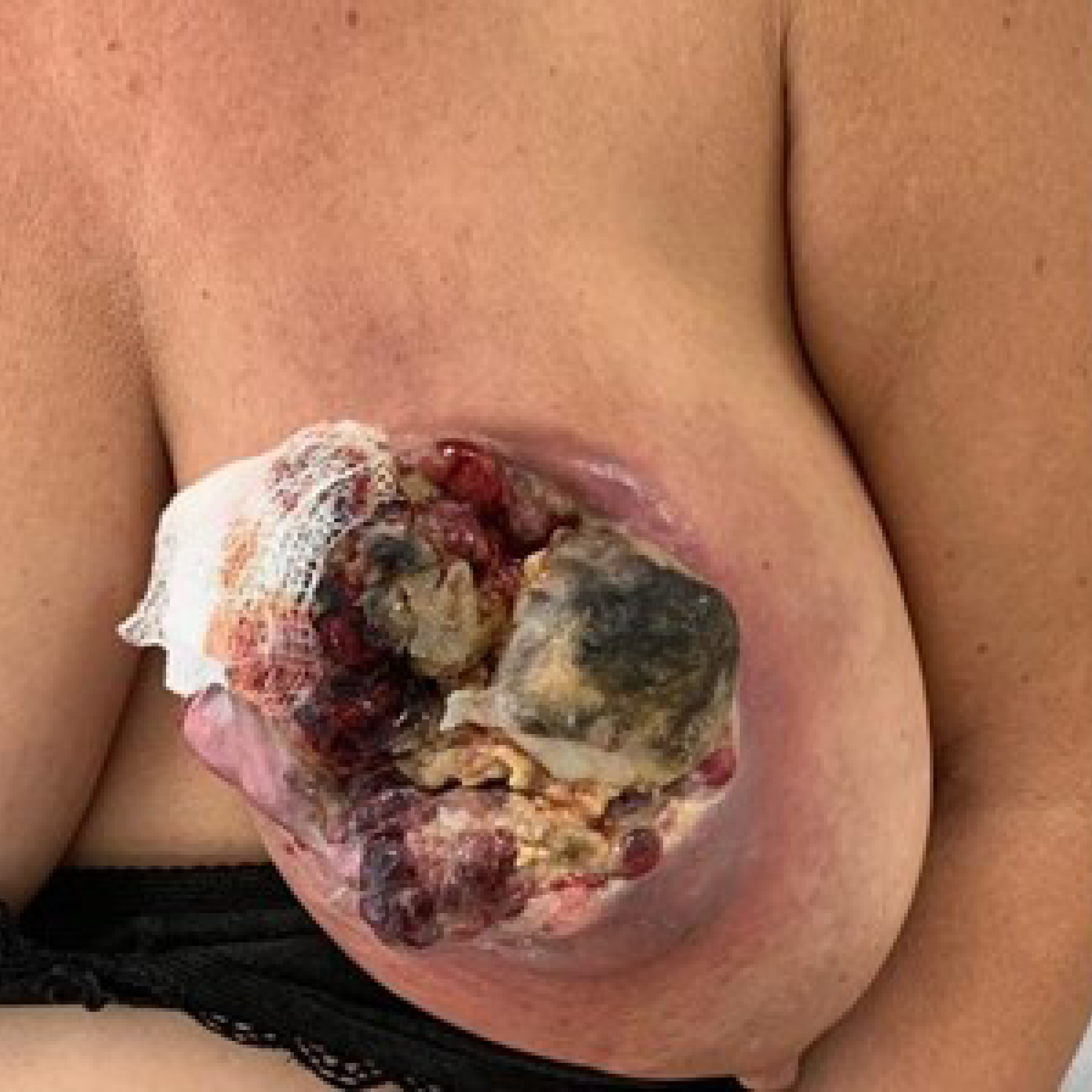
Figura 2. Segundo ciclo de carboplatina + paclitaxel/semanal + pembrolizumabe.
Fonte: arquivo da autora.
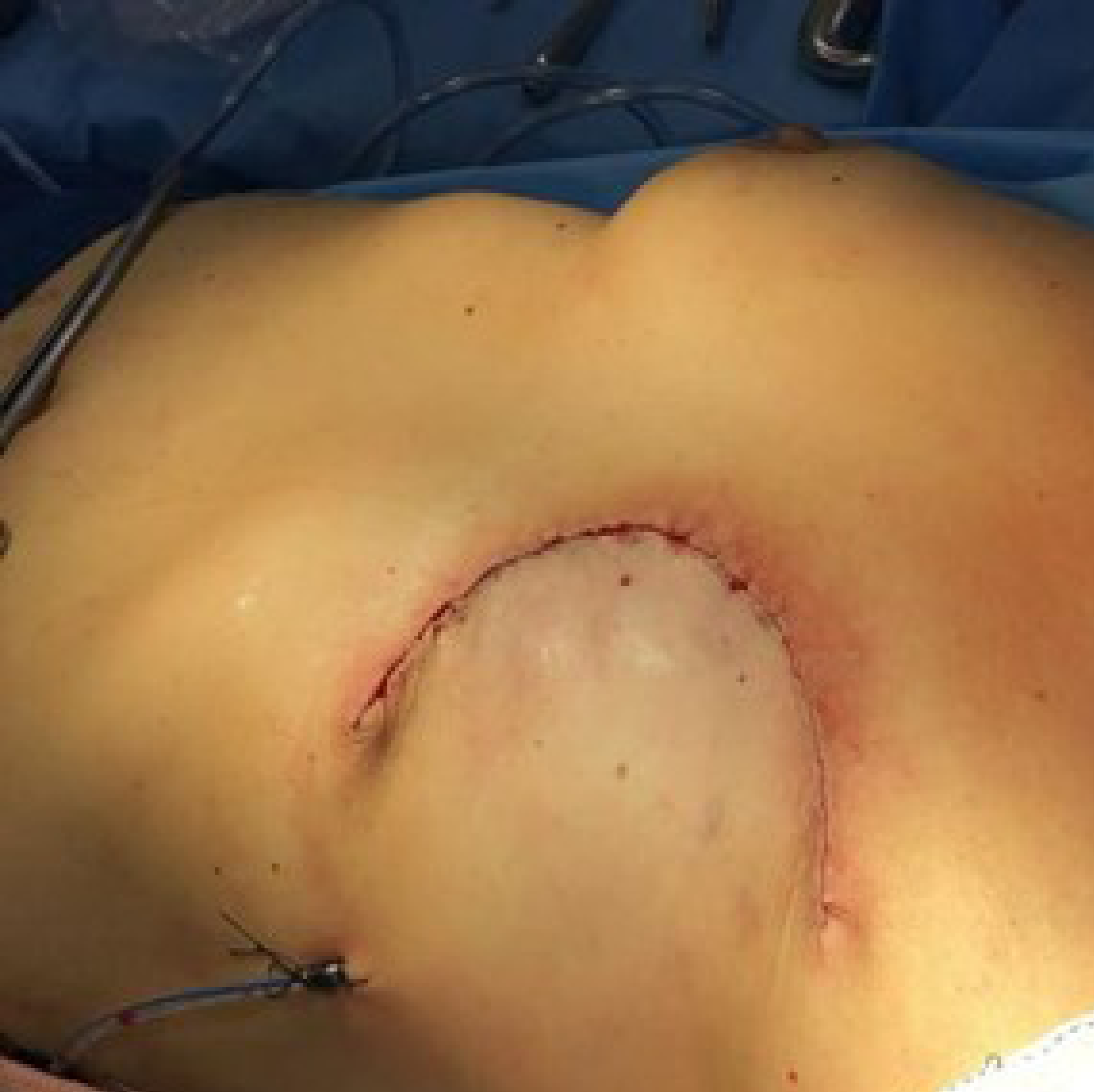
Figura 3. Mastectomia esquerda.
Fonte: arquivo da autora.
Paciente foi submetida a mastectomia esquerda + linfadenectomia axilar em 30/09/2022, tendo sido mantido pembrolizumabe adjuvante (Figura 3).
Após mastectomia esquerda + linfadenectomia axilar esquerda (30/09/2022):
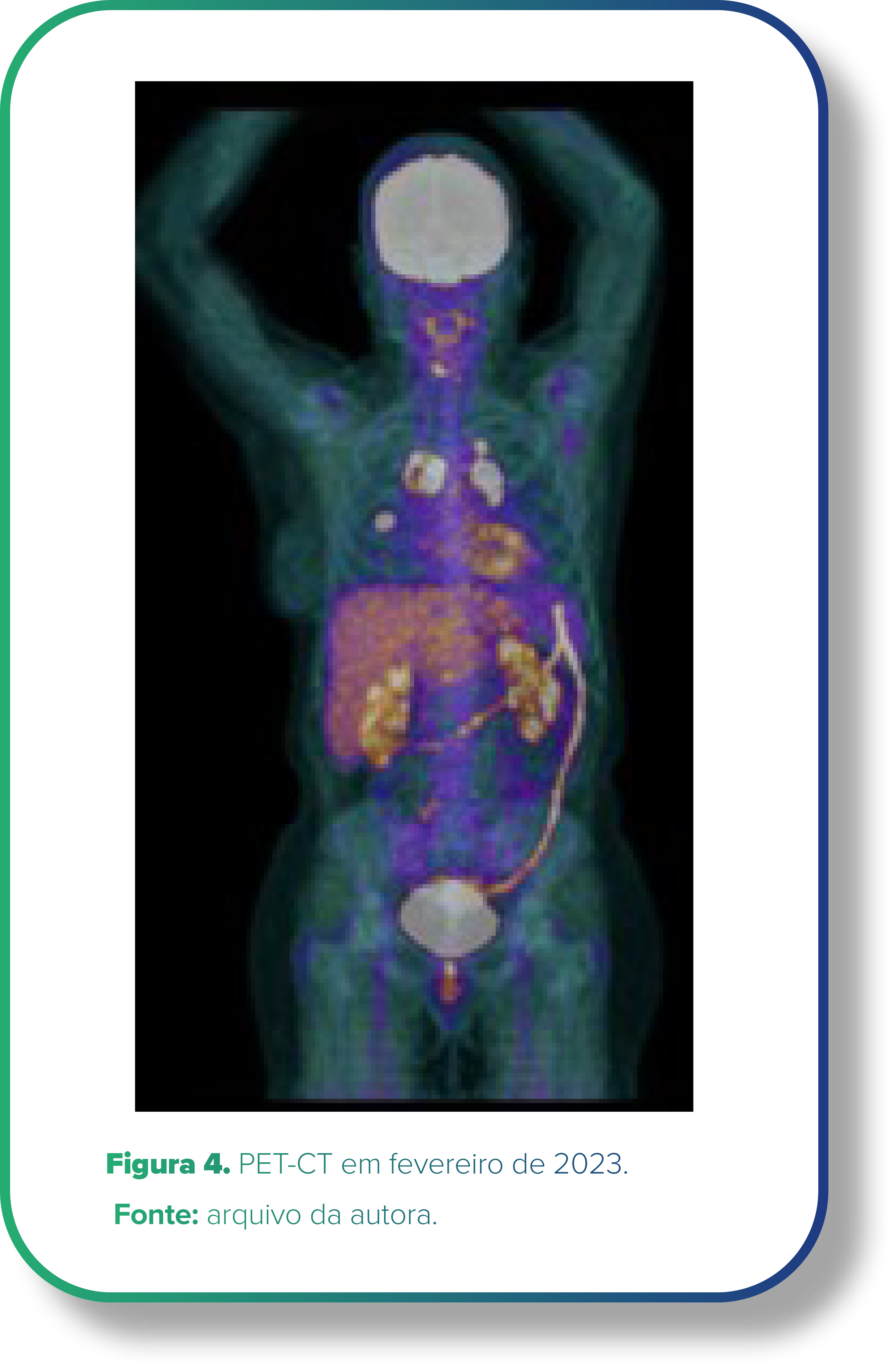
Em exame de seguimento, após tomografia suspeita, PET-CT em 01/02/2023 (Figura 4) evidenciou linfonodomegalias mediastinais, paratraqueal superior e inferior à direita, para-aórticas, hilo pulmonar esquerdo e axila esquerda e nódulos pulmonares (maiores que 2,3 x 2 cm; SUV: 9,21) compatíveis com disseminação secundária.
Início de tratamento com Trodelvy®, com resposta metabólica parcial significativa após três ciclos
Diante da progressão após mais de duas linhas de tratamento (resistência a antracíclico, paclitaxel, platina e pembrolizumabe), foi indicada sacituzumabe govitecana (Trodelvy®) aos moldes do estudo ASCENT,2 tendo sido iniciada em 27/03/2023.
Na primeira avaliação de resposta após três ciclos, PET-CT em 25/05/2023 (Figura 5) evidenciou resposta metabólica parcial significativa.
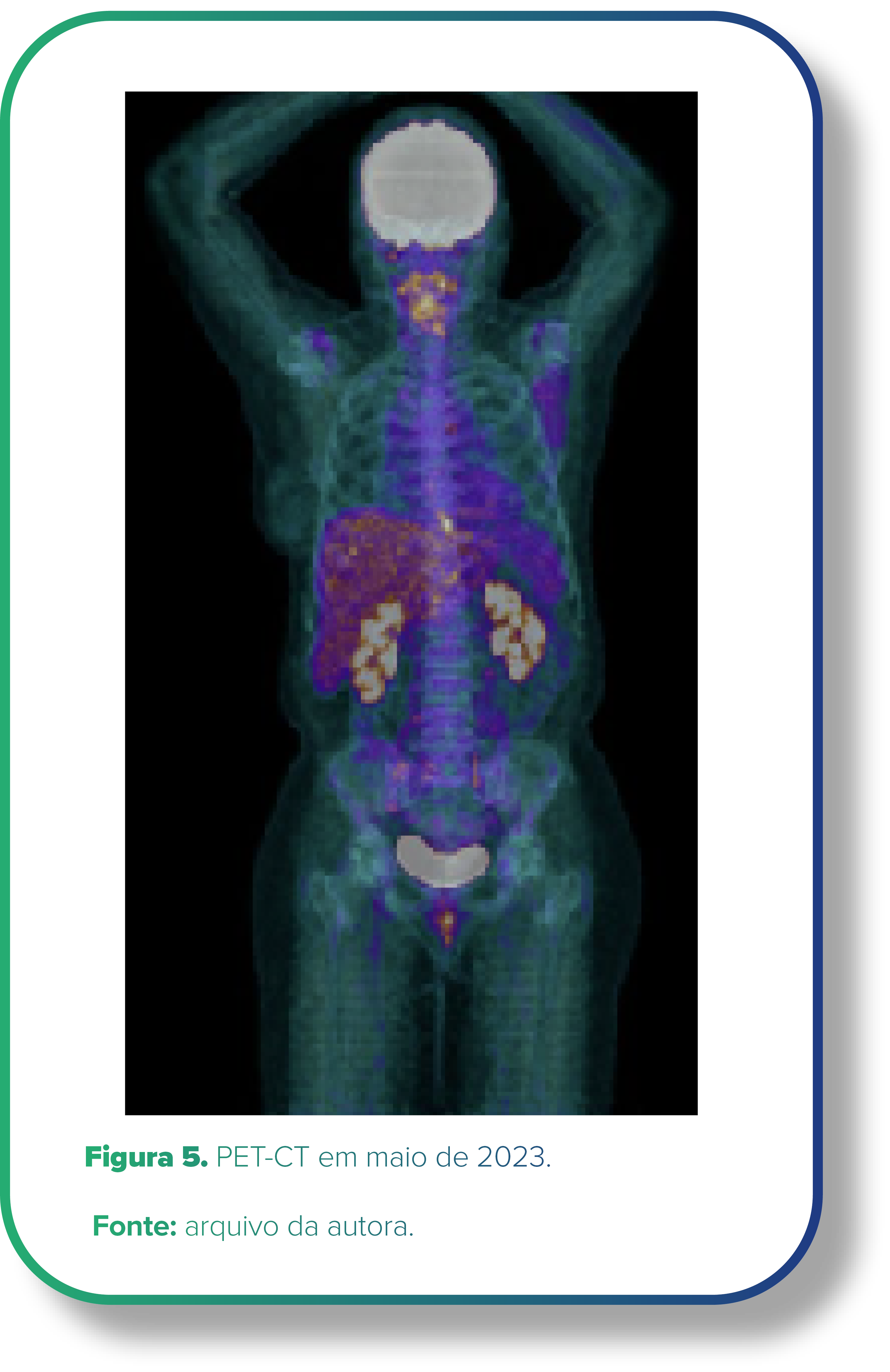
PET-CT (25/05/2023): involução das linfonodomegalias observadas no exame prévio na axila esquerda, mediastinal para-aórtica e no hilo pulmonar esquerdo. Houve involução do hipermetabolismo glicolítico e redução das dimensões dos nódulos pulmonares no lobo médio. Persistiu linfonodomegalia paratraqueal à direita (2R e 4R), com dimensões estáveis.
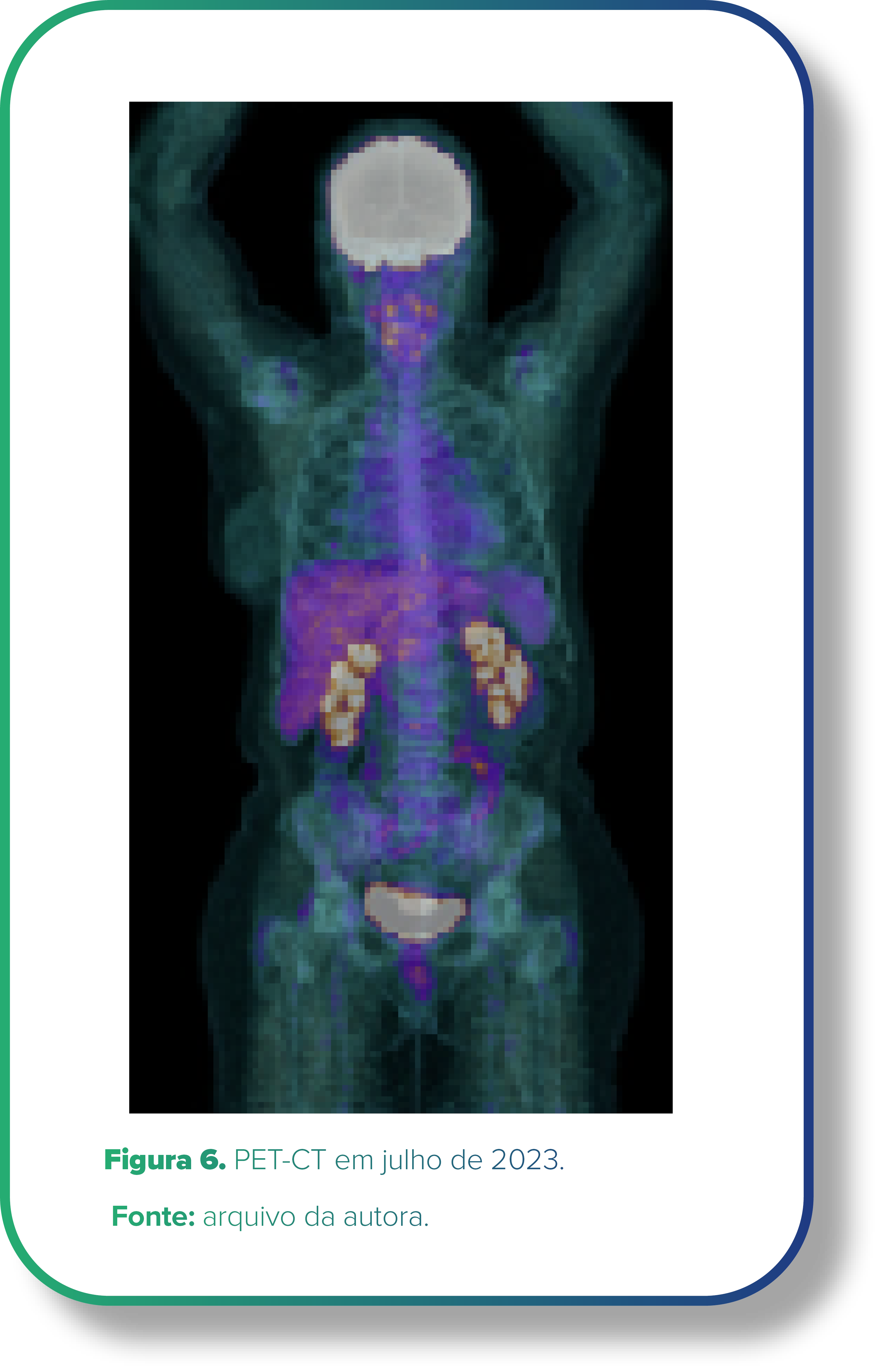
Em 21/07/2023, novo PET-CT (Figura 6) evidenciou resposta adicional em linfonodos paratraqueais. Paciente segue assintomática, com boa tolerância ao tratamento instituído.
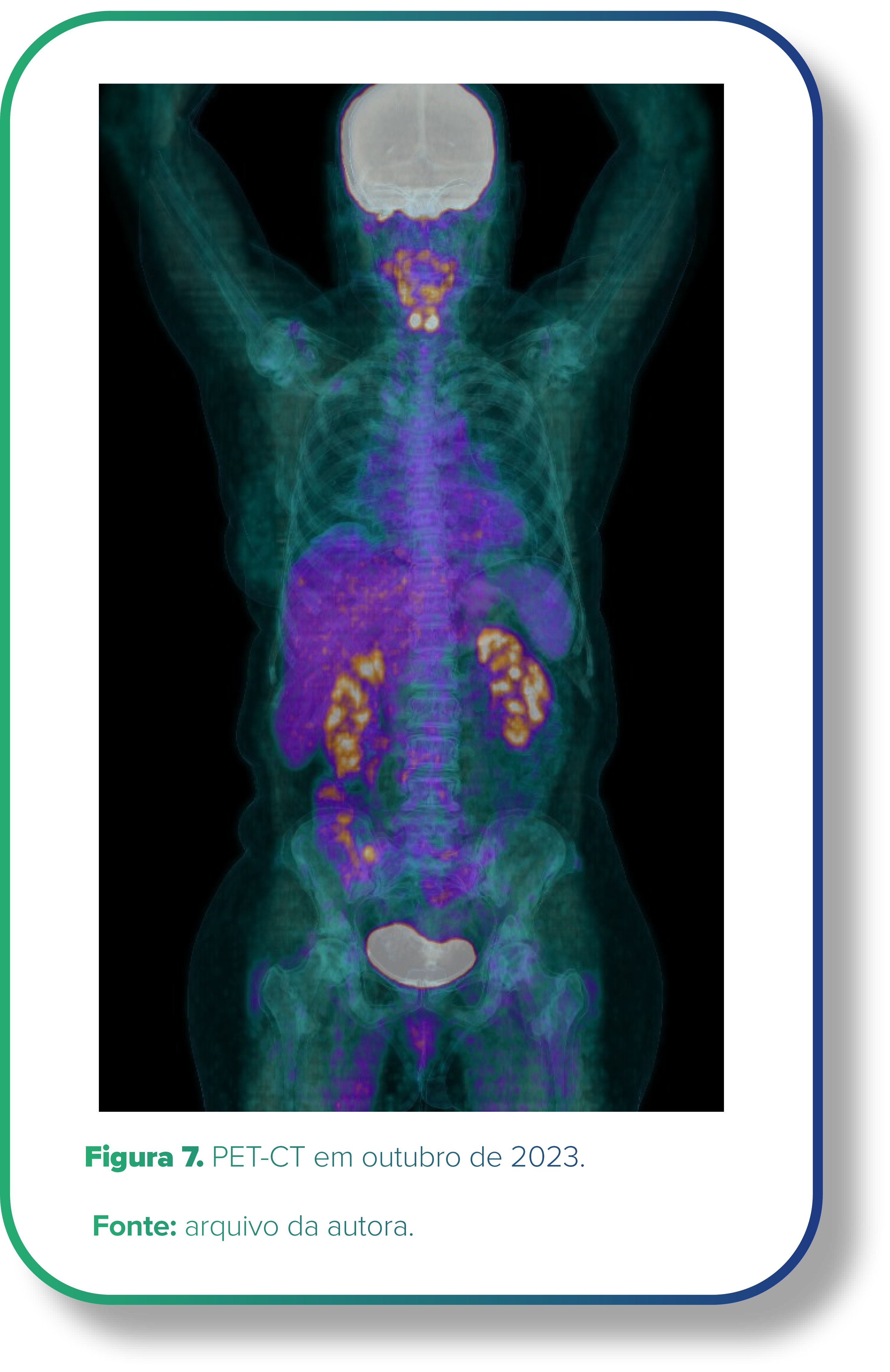
Em 23/10/2023, a paciente foi submetida novamente ao PET-CT para reestadiamento oncológico, com manutenção da resposta completa (Figura 7).
DISCUSSÃO
O ASCENT2 foi um estudo randomizado de fase III, aberto, que avaliou 529 pacientes com tumor de mama triplo-negativo refratário a duas ou mais terapias sistêmicas anteriores, incluindo pelo menos uma para a doença avançada. Os resultados do estudo corroboraram a aprovação do medicamento Trodelvy® para o tratamento de pacientes com câncer de mama triplo-negativo irresecável ou metastático (CMTNm), conforme indicação aprovada em bula.3 Recomendado pelo guideline da National Comprehensive Cancer Network (NCCN),4 categoria 1 para pacientes CMTNm com a indicação de tratamento para pacientes que receberam duas ou mais terapias sistêmicas anteriores, incluindo pelo menos uma para doença avançada. Também recomendado pelo guideline da European Society for Medical Oncology (ESMO)5 para CMTN, a partir da segunda linha na versão 1.1 publicada em maio de 2023.5 Há, ainda, dados de uma revisão sistemática e metanálise publicada em 2023,6 que demonstram a eficácia e a segurança do uso dos anticorpos fármaco-conjugados no câncer de mama.




De acordo com a bula aprovada: a SG foi 12,1 meses versus 6,7 meses, em pacientes tratados com sacituzumabe govitecana e QT, respectivamente (HR: 0,51; IC 95%: 0,41 a 0,62).
IC: intervalo de confiança; HR: razão de risco; SLP: sobrevida livre de progressão; SG: sobrevida livre de progressão; QT: quimioterapia.
Adaptada de: Bardia A, et al., 2021.2
Esse caso clínico ilustra o comportamento agressivo do tumor metaplásico,7 triplo-negativo, resistente a duas linhas de tratamento. A indicação de sacituzumabe govitecana (Trodelvy®) foi baseada no referido estudo ASCENT, no qual houve falha a pelo menos duas linhas de tratamentos prévios, sendo pelo menos uma delas para doença avançada.2,3
Ao abordar melhor o mecanismo de ação desse anticorpo fármaco-conjugado (ADC, do inglês, antibody-drug conjugation), é válido ressaltar o papel do biomarcador TROP-2, o qual é expresso na maioria dos cânceres de mama, regulando o crescimento, a invasão e a propagação do câncer por várias vias de sinalização. No CMTN, há alta expressão do TROP-2, um biomarcador alvo terapêutico de sacituzumabe govitecana (Trodelvy®). Uma vez que a porção de anticorpo se liga a TROP-2, o complexo é internalizado para o meio intracelular e o fármaco é liberado, resultando em dano ao DNA, apoptose e morte celular.2
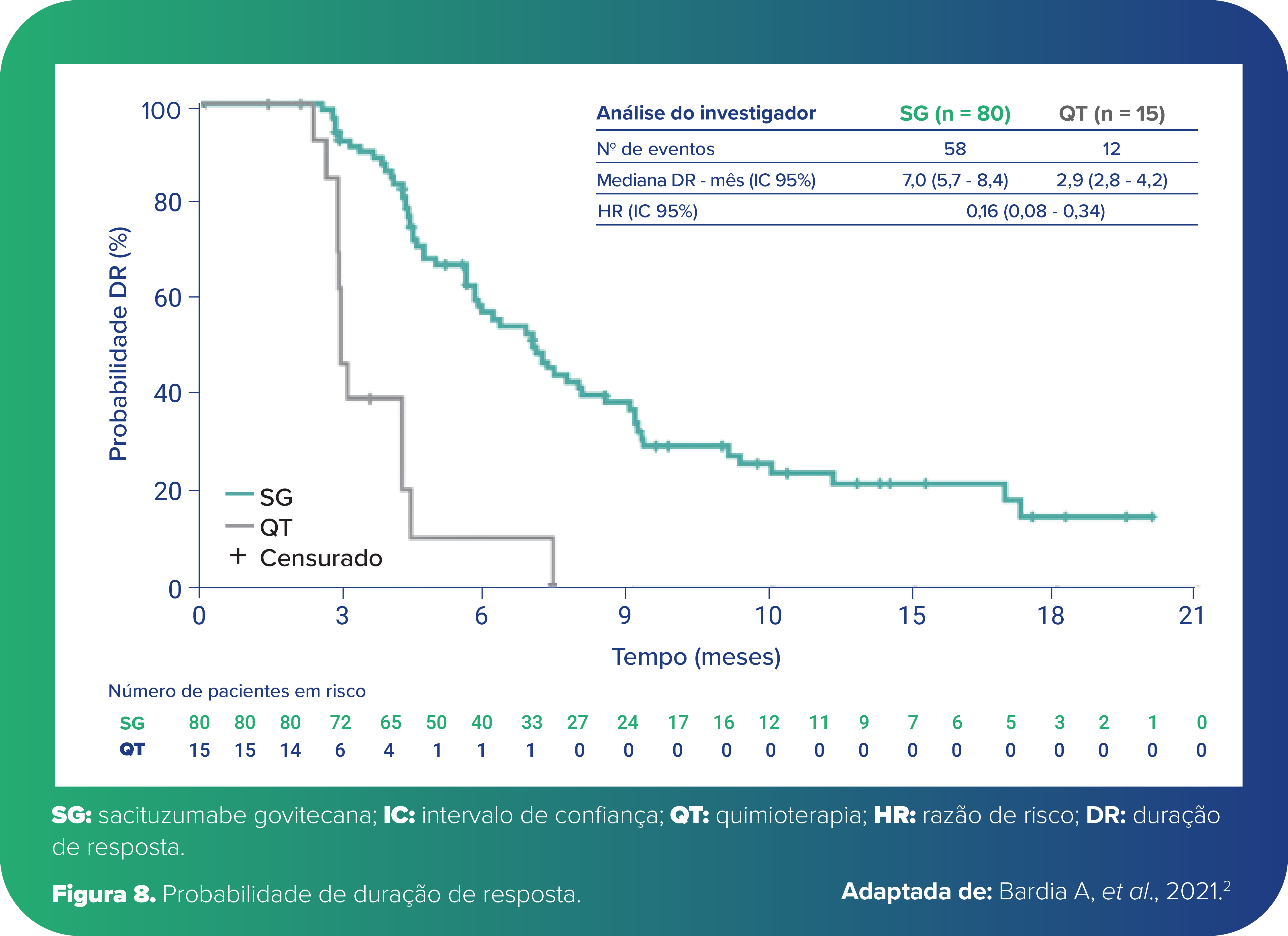
A paciente apresentou resposta ao ADC na primeira avaliação, conforme demonstrado pelos resultados do estudo ASCENT, no qual as curvas de probabilidade de resposta estão separadas em primeira análise2 (Figura 8).
Os eventos adversos mais frequentes descritos no referido estudo foram mielossupressão (63% de qualquer grau e 34% de grau 3) e diarreia (59% de qualquer grau e 10% de grau 3). De maneira geral, as taxas de eventos adversos foram muito baixas, levando à descontinuação do tratamento em apenas 5% dos pacientes.2
A paciente em questão vem apresentando boa tolerância ao tratamento, realiza hemograma antes de cada administração do medicamento, sem apresentar evidências de mielossupressão até o momento. Mantém hábito intestinal preservado. O evento adverso mais relevante observado foi alopecia grau 2, evento que esteve presente em 46% dos pacientes do estudo.
Desde o início ao uso de Trodelvy®, em março de 2023, os exames de avaliação de resposta PET-CT evidenciam boa resposta ao tratamento. Último PET-CT realizado foi em 23/01/2024, mantendo resposta completa.
Referências
1. Schmid P, Cortes J, Pusztai L, McArthur H, Kümmel S, Bergh J, et al. Pembrolizumab for early triple-negative breast cancer. N Engl J Med. 2020;382(9):810-21.
2. Bardia A, Hurvitz SA, Tolaney SM, Loirat D, Punie K, Oliveirar M, et al. Sacituzumab govitecan in metastatic triple-negative breast cancer. N Engl J Med. 2021;384(16):1529-41.
3. Bula de Trodelvy® aprovada pela Anvisa.
4. NCCN [homepage da internet] Login. Disponível em: https://www.nccn.org/professionals/physician_gls/pdf/breast.pdf. Acesso em: 19 out. 2023.
5. ESMO [homepage da internet]. Clinical Practice Guideline Metastatic Breast Cancer. Disponível em: www.esmo.org/guidelines/guidelines-by-topic/breast-cancer/metastatic-breast-cancer. Acesso em: 19 out. 2023.
6. Afzal F, Aiman W, Zahoor H, Bajwa AR, Kazmi SH, Anwar A, et al. Efficacy and safety of antibody-drug conjugates in triple-negative and HER-2 positive breast cancer: a systematic review and meta-analysis of clinical trials. Breast Dis. 2023;42(1):121-36.
7. Reddy TP, Rosato RR, Li X, Moulder S, Piwnica-Worms H, Chang JC. A comprehensive overview of metaplastic breast cancer: clinical features and molecular aberrations. Breast Cancer Res. 2020;22(1):121.
As opiniões emitidas nesta publicação são de inteira responsabilidade das autoras e não refletem, necessariamente, a opinião da Conectfarma® Publicações Científicas Ltda. nem do Laboratório Gilead.

© 2024 Conectfarma® Publicações Científicas Ltda. | Todos os direitos reservados. LB 12379-E/24